Mécan’OS : si tu ne peux pas l’avoir, (re)construis le ! Mathématiques et biomécanique : une histoire d’os
Sur un projet de recherche mené par Laurent Pujo-Menjouet, Université Claude Bernard Lyon 1 et Jean-Philippe Berteau, City University of New York : comprendre, par la modélisation mathématique, le processus complexe de formation d'une partie élémentaire de l'os, et l'impact sur ses propriétés mécaniques à l'échelle macroscopique.
Le vieillard et ses enfants
"Toute puissance est faible, à moins que d'être unie", c'est par ce premier vers que Jean de La Fontaine nous embarque dans la fable du vieillard et ses enfants. L'histoire, rappelons-nous, est celle d'un père d'âge bien avancé qui sent poindre la fin. Il convoque ses trois fils, leur présente un fagot composé de plusieurs baguettes (des dards dans la fable) et leur demande tour à tour de tenter de le rompre (Fig.1). Les solides gaillards malgré leurs efforts se rendent à l'évidence : même le plus costaud d'entre eux n'y parvient pas. Le vieil homme reprend l'objet, défait le nœud, et brise une à une chacune des brindilles avec une facilité déconcertante : "Il sépare les dards, et les rompt sans effort. Vous voyez, reprit-il, l'effet de la concorde". La fable cependant finit mal, le père meurt, les enfants ne retiennent pas la leçon et perdent tout leur bien.
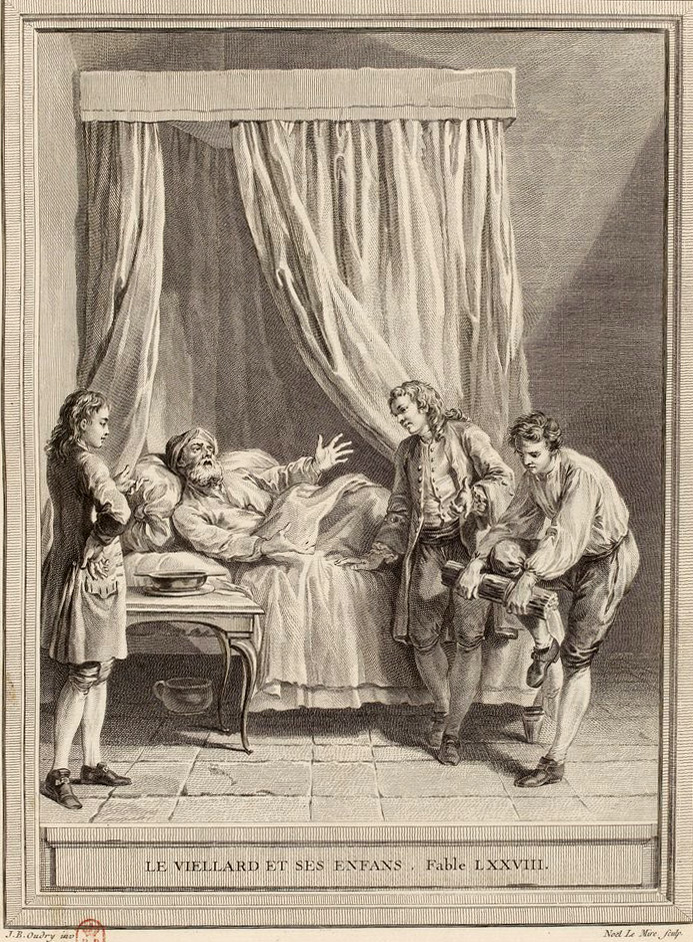
Cet apologue apparaît toujours comme une évidence quand j'évoque la genèse du projet de recherche que mon collègue Jean-Philippe Berteau de la City University of New York et moi avons initié il y a un peu plus de huit ans déjà. L'objectif était très simple : comprendre, par la modélisation mathématique, le processus complexe de formation d'une partie élémentaire de l'os, et l'impact sur ses propriétés mécaniques à l'échelle macroscopique. Un des premiers projets financés sur ce sujet intitulé Micr'os Macr'os (Labex MiLyon) résumait, à juste titre littéralement, cette problématique.
Afin de répondre à cette question, deux approches nous semblaient nécessaires : la première, microscopique décrivant la minéralisation des structures élémentaires d'un point de vue moléculaire (les brindilles), et la deuxième, macroscopique détaillant les qualités d'élasticité et de résistance d'un os (les fagots ou plutôt ici les fag'os). La dernière dépendant fortement de la première, coupler le modèle apparaissait comme une évidence. Toutefois, comme rien, dans la littérature, n'existait sur le sujet, nous allions devoir faire preuve de créativité.
Afin de maîtriser le sujet, il fallait me plonger tête baissée dans le vif du sujet. Mes bases biologiques assez scolaires sur ce thème allaient m'amener à explorer l'état actuel des connaissances avant de me hasarder dans la rédaction d'un modèle.
Faisons brièvement cette démarche ensemble si vous le voulez bien.
Sacerdoce
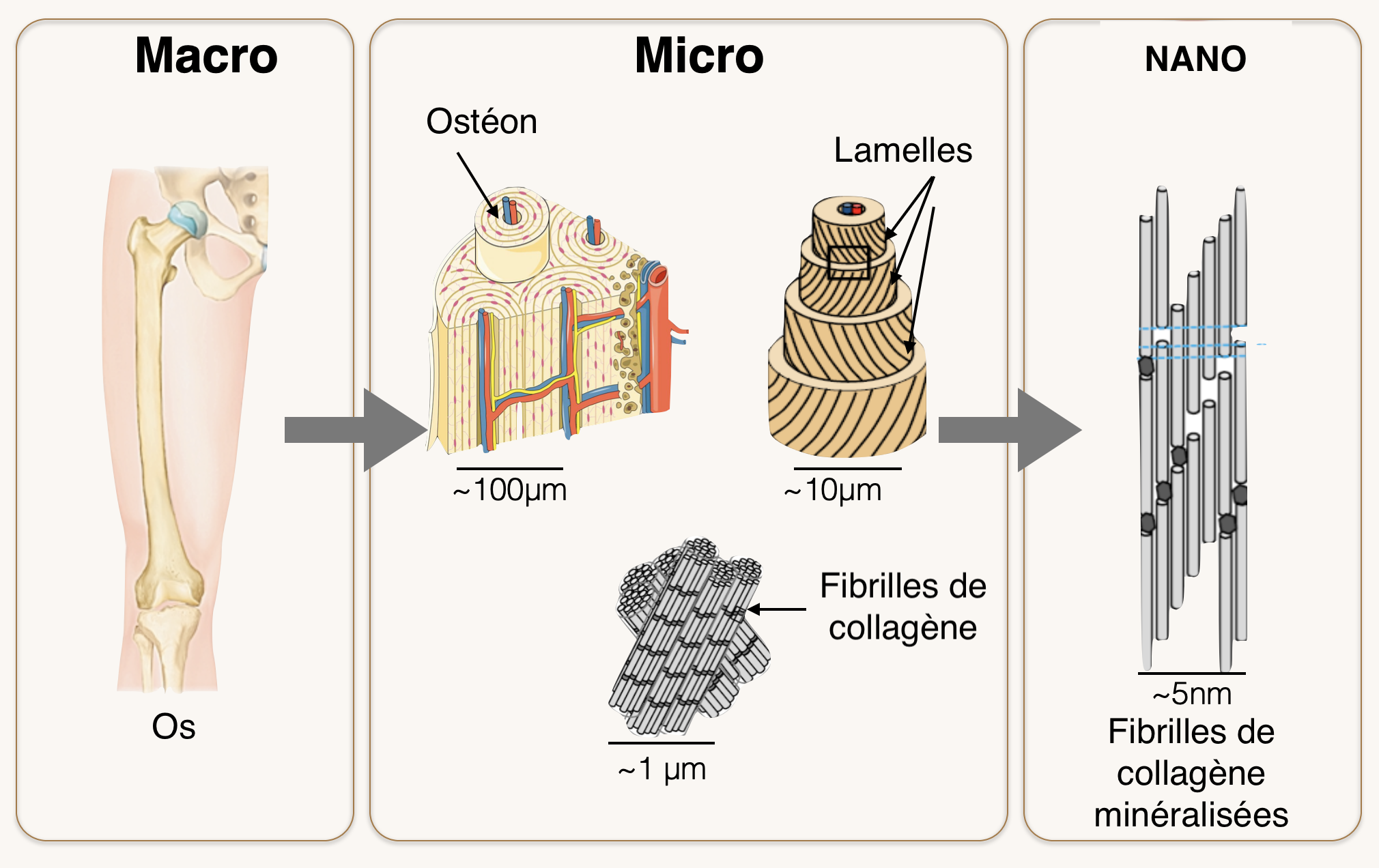
Nous, humains et autres vertébrés de ce monde sommes tous pourvus d'os pour certains, ou arêtes pour d'autres. En les décortiquant un peu, nous observons qu'ils sont constitués de cylindres, accrochés les uns aux autres, appelés ostéons. En nous penchant d'un peu plus près, nous constatons que des fibres les composent, elles-mêmes organisées en assemblages de fibriles minéralisées. Ce sont nos brindilles de la fable (voir figure 2).
Cet enchevêtrement minéralisé que nous pourrions supposé inerte, est non seulement organisé mais bel et bien vivant. Il repose sur une base simple : une matrice de collagène, protéine très souples qui confère cette propriété d'élasticité aux jeunes squelettes. Rappelez-vous, enfants, les chutes sans grande gravité qui pourraient s'avérer désormais fatales à votre squelette d'adulte.
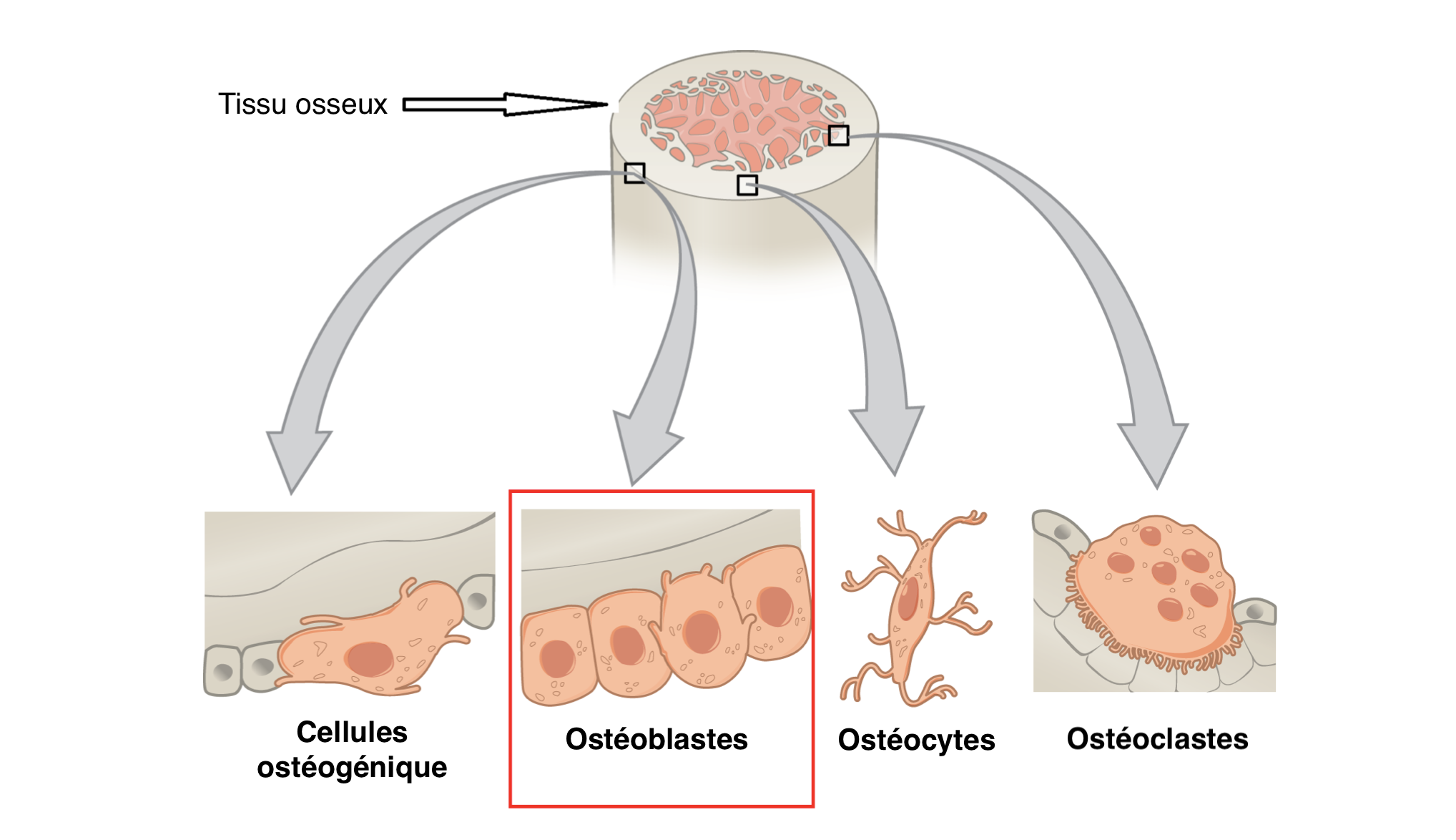
Sur cette matrice se déposent les cellules les plus essentielles à son durcissement progressif. Sans elles, point de salut, nous ramperions comme des limaces primitives. Appelées ostéoblastes, leurs missions qu'elles accomplissent sans faille, véritable sacerdoce consiste à minéraliser graduellement le collagène par un mécanisme complexe. Bourrées de capteurs, elles détectent continuellement la dureté de leur support. Très souple au début, le signal est donné de déclencher en son sein un ensemble de réactions en chaînes d'interactions chimiques. En résulte alors la production de plusieurs protéines clés qui vont alors récupérer le calcium environnant dans le corps et le précipiter en une forme minérale pour le loger dans les moindres recoins de la matrice.
Arrêtons-nous un instant sur ce passage. Imaginez-vous que soudainement notre machinerie interne se dérègle et que les ostéoblastes prennent le dessus sur notre organisme. Notre corps se transformerait alors en statue de pierre. Eh bien, cette pathologie existe, elle s'appelle fibrodysplasie ossifiante progressive (FOP) ou maladie de l'homme de pierre. Mutation génétique assez rare heureusement, elle offre à ses victimes une espérance de vie moyenne de 40 ans.
Refermons cette parenthèse, et revenons au cas normal où tout se passe à peu près bien. Une fois leur tâche accomplie, un message chimique est envoyé à d'autres cellules, appelées ostéoclastes qui rappliquent illico pour détruire l'ouvrage fraîchement conçu. À l'instar de bulldozers, ils creusent en aspergeant d'une substance acide les surfaces minéralisées. Repartis comme ils étaient venus, laissant un tranchée propre qui rameutera les ostéoblastes. Telles des Sisyphe, obstinés, elles se remettent à cette tâche sans faillir ou presque, commençant par recouvrir les trous béants de collagène puis les minéralisant progressivement. L'âge avançant en effet, le mécanisme se grippe un peu. L'efficacité et la réactivité se font sentir et nous glissons progressivement vers une forte minéralisation de nos os (voir figure 3).
En quoi cela peut-il être gênant ? La réponse est simple si l'on repense à la métaphore des brindilles. Encore bien fraîches, elles sont souples et il faut un gros effort pour les briser. Faites les sécher, ou dans notre cas, minéraliser, vous perdrez la souplesse et serez beaucoup plus exposés à des fractures. Mais alors comment éviter ça ? Ou en d'autres termes, comment conserver une jeunesse salvatrice à notre squelette ? La solution, élémentaire réside en un mot : bouger. L'activité quelle qu'elle soit, comme le sport en général ou tout ce qui y ressemble permet de créer des microfissures dans notre ossature. Ces dernières sonnent un signal d'alarme aux ostéoclastes pour rendre les failles plus nettes. Creusant, nettoyant, elles font place nette à une nouvelle matrice de collagène, qui sera progressivement minéralisé par les ostéoblastes. Retrouvant la souplesse d'antan, nous avons ainsi la possibilité d'éloigner les risques de fracture.
Autre avantage de ce processus. Des signaux chimiques envoyés dans l'organisme suite aux microfractures, vécus comme des micro traumatismes permettent non seulement un renforcement musculaire, mais aussi neuronal. Tout provient de nos ancêtres préhistoriques : bouger signifiait être à la fois rapide pour s'enfuir ou attaquer, et alerte afin d'être le plus réactif possible.
Rester sédentaire est donc un mauvais signal pour le corps qui se minéralise (on ne compte pas ici les pathologies liées à l'ostéoporose, ou au manque de minéralisation comme la maladie des os de verres), perd de sa masse musculaire et relâche les connections dans le cerveau.
Quel est le processus de vieillissement de nos os? Comment les garder aussi jeunes que possible? Telles étaient les questions initiales de ce projet. Les applications se sont progressivement étendues vers d'autres problématiques tout aussi importantes allant de la modélisation des pathologies liées à l'os à la fabrication de prothèses innovantes. Partant du constat qu'un adulte ne possède pas un squelette aussi souple que les enfants, pourquoi ne proposerions-nous pas des prothèses qui leurs sont adaptées. Par accident, ou dans des zones de guerres, les plus jeunes sont malheureusement trop souvent victimes de pertes de membres.
Les remplacer avec des propriétés mécaniques adéquat semble être du bon sens. Alors pourquoi ne pas tenter de créer un matériau biocompatible à partir de matrices de collagènes et d'ostéoclastes aux ordres de certains signaux chimiques. Ceci nous permettrait de stopper la minéralisation à tout moment et ainsi obtenir la rigidité souhaitée. C'est un des buts ultimes de notre projet.
Substantifique moelle
Les motivations posées, il ne reste plus qu'à formaliser le problème en équations. L'objectif est alors à ce stade de comprendre les interactions à chaque échelle, les décrire par un modèle le plus simple possible tout en conservant la substantifique moelle du système biologique. Puis enfin, prédire les comportements à la fois moléculaires et mécaniques suivant les différentes propriétés dans les conditions saines, comme les pathologiques.
Les références de modélisation sur ce sujet étant assez maigres, un paysage quasiment vierge s'offre à nous. À la fois abyssal et excitant, l'entreprise doit selon notre équipe avancer par étapes simples pour aboutir à un modèle qui nous l'espérons sera le plus complet possible.
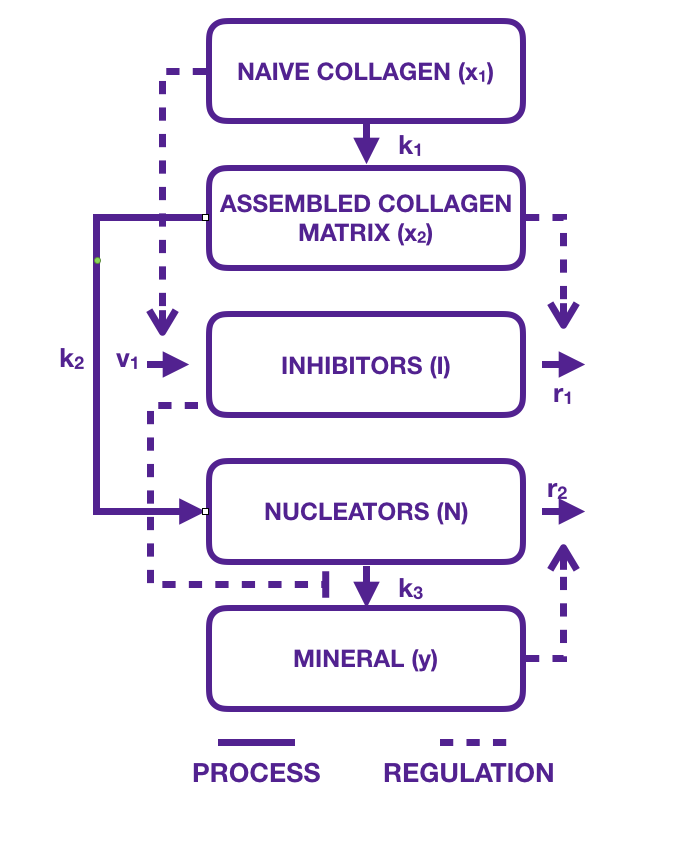
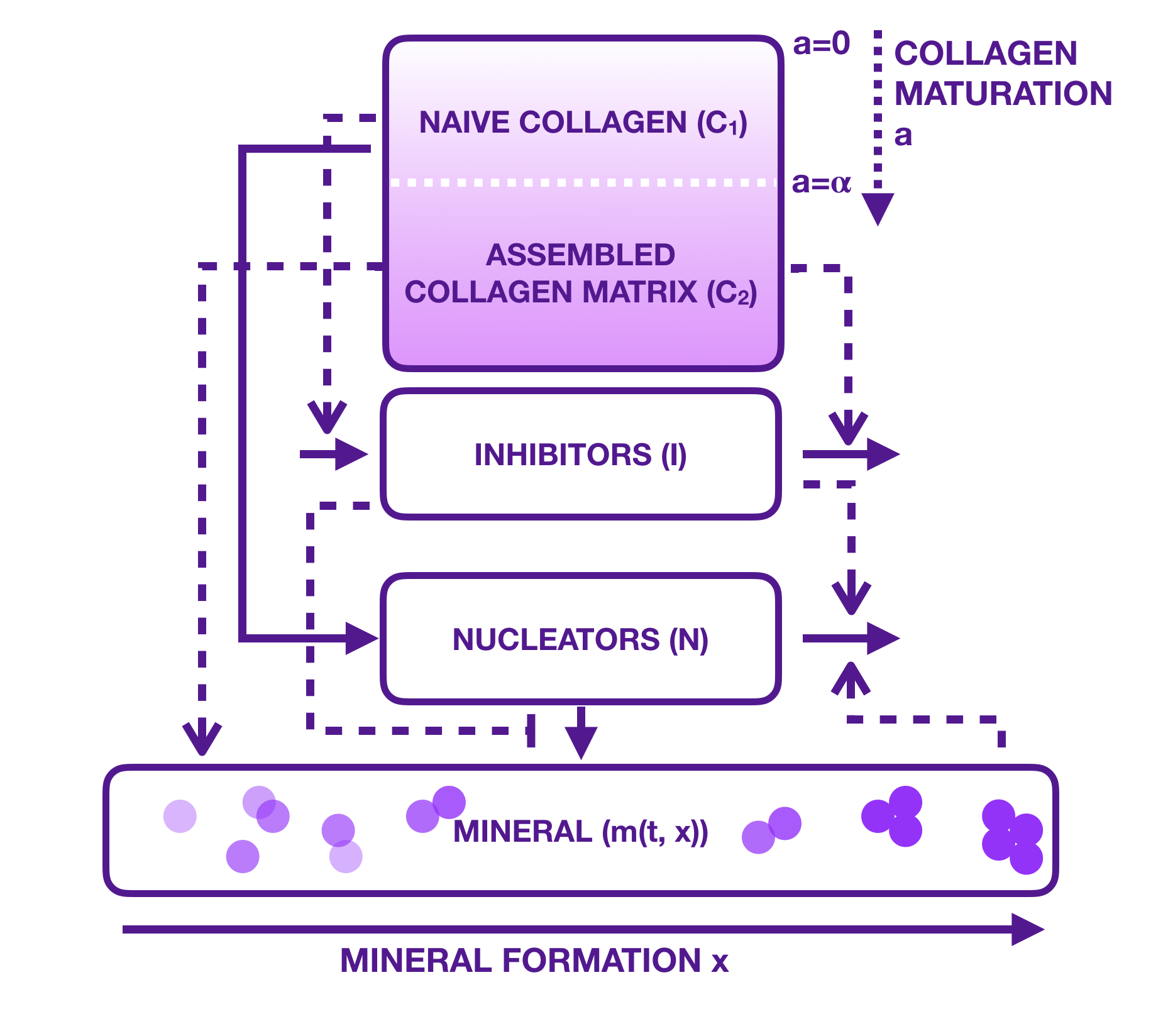
La base de notre travail est un modèle publié par Komarova et al. [3] en 2015. Composé d'un système de 5 équations différentielles, le modèle compartimental est dépeint de la façon suivante : sur une matrice de collagène vierge, appelée également naïve, les ostéoblastes commencent le travail de minéralisation. Ils la transforment progressivement en assemblage mature. Des inhibiteurs empêchant le calcium de se minéraliser sont fortement présents au début de l'expérience. Ces protéines appelées SIBLING (Small Integrin-BindING ligand, N-linked glycoproteins), comme par exemple l'ostéopontine, sont des inhibiteurs de la minéralisation, mais en deviennent des promoteurs fortuits lorsqu'ils se font absorber sous la surface des collagènes. Une fois inactivés ou dégradés, ils laissent libre place aux nucléateurs dont le rôle est de précipiter le calcium avec du phosphate pour créer des cristaux d'hydroxyapatite [Ca$_{10}$ (PO$_4$ )$_6$ (OH)$_2$ ]. Guidés par la structure de la matrice, leur organisation n'est pas aléatoire, mais suit un mouvement prédéfini qui donnera par la suite toute les propriétés requises biomécaniques de l'os. Absorbés eux aussi par la matrice en se minéralisant eux même les nucléateurs se figent progressivement ralentissant ainsi leur action de minéralisation. Les cristaux quant à eux, sont décrits dans un compartiment et leur population croît linéairement par rapport aux nucléateurs mais inversement proportionnel à la quantité d'inhibiteurs (voir figure 4).
Le décor étant planté, les acteurs prêts à entrer en scène, les trois coups peuvent être frappés. Collagène naïf, inhibiteurs, nucléateurs, minéraux et collagène matures, voici en 5 actes, l'opération d'un processus vieux de plusieurs millions d'années qui se met en branle. Imperturbable, bien rodé, et sans faillir ou presque, il a construit la charpente de nos ancêtres et continuera durant encore longtemps sa mission.
Ce système, que nous appellerons modèle de Komarova, somme toute assez simple n'offre pas de grande difficulté pour être analysé, même si les auteurs à ce stade ne se penchèrent que sur les simulations numériques de l'évolution en temps, de cas sains et pathologiques. Tout autant intéressés par le comportement asymptotique que le régime transitoire, assez informatif, ils ont tenté de trouver les causes et effets de l'ostéogenèse imparfaite que nous avons déjà croisé plus haut sous le nom de maladie des os de verres (trop grande minéralisation de l'os), et de l'ostéomalacie (montrant au contraire une déficience de la minéralisation rendant les os mous).
Il sortit de la vie comme un vieil hareng saur
Komarova et ses co-auteurs nous apportaient la trame nécessaire à notre réflexion. Il ne restait plus qu'à nous en inspirer pour élaborer notre vision un peu plus détaillé que le modèle compartimental originel [3].
Le constat de départ était le suivant : plusieurs simplifications étaient trop drastiques. Nous pensions raisonnables de nous rapprocher d'un plus près de la réalité biologique sans toutefois sombrer dans des abîmes de complexités dont nous ne pourrions pas nous extirper. Illustrons ce propos par des exemples précis. Les collagènes naïfs et matures ne pouvaient à nos yeux pas se trouver dans deux compartiments différents. Il s'agissait exactement de la même matrice qui se minéralisait progressivement, un peu comme le vieillissement naturel d'une population. Nous n'avions alors qu'à proposer un seul compartiment, celui du collagène avec une variable de structure de minéralisation que nous assimilions à l'âge. L'équation qui émergeait naturellement était celle de Sharpe-Lotka-Mc Kendrick, dans lequel aucune dégradation de la matrice n'a lieu. La quantité initiale étant prédéfinie par expérience, seule sa destruction par des ostéoclastes laisserait place à des nouvelles conditions aux bords. Notre choix était de ne pas introduire ces derniers dans notre modèle mais plutôt de nous pencher seulement sur la minéralisation continue par l'opération des ostéoblastes. La condition aux bords se trouvait donc être nulle. Rien donc ne se perdait, ni se créait. Juste un glissement de notre population vers un âge (ou plutôt ici, une fermeté avancée). Un transport, juste ça. C'est ainsi que le collagène se laisse aller dans la course du temps. Sous l'influence des inhibiteurs et des nucléateurs, dont nous avons conservés la définition et l'action dans notre travail, le mécanisme de durcissement pouvait alors s'initier.
Mais voilà qu'un autre point de divergence de vue avec le modèle de Komarova apparaissait. Les minéraux chez eux n'était considérés là encore que de façon simpliste: tous de même taille, dont la population augmentait et faisait tour à tour disparaître les inhibiteurs et les nucléateurs.
Notre proposition était alors d'aller plus loin. Les cristaux, créés par la précipitation du calcium et du phosphate pouvaient parfaitement s'agréger par blocs entiers. Une structure en taille avec allongement et agrégation s'imposait tout naturellement. Le compartiment des minéraux devait, selon nous, se présenter sous la forme d'une équation classique de Smoluchowski avec quelques ajustements spécifiques à notre problème. Leur croissance devait posséder une vitesse $V$ dépendante de la maturité de la matrice correspondant ici à la proportion de collagène au dessus d'un certain âge (ou plutôt d'un seuil de minéralisation donné, dont la valeur était déterminée par le biologiste) par rapport à la matrice totale. Cette proportion notée $F(t)$ évoluait ainsi avec le temps passant de $0$ à $1$ une fois tout l'ensemble fraîchement façonné en entier.
La fonction $V$ était alors proposée sous forme de cloche: minimale (proche de $0$ au début, puisque le processus n'a pas tout à fait commencé), elle prenait un rythme de croisière allant croissant jusqu'à un certain seuil de $F(t)$, où son maximum était atteint. Elle décroissait pour se figer à $0$ une fois la matrice complètement minéralisée. D'un autre côté, l'agrégation pouvait suivre la loi décrite dans les hypothèses de Komarova à savoir, une croissance linéaire vis à vis des nucléateurs et sous forme de fonction de Hill en décroissant par rapport aux inhibiteurs mais cette fois-ci, pas appliquée à la variation de la population mais bel et bien à l'augmentation de sa taille par agrégation. La condition initiale indiquait que l'expérience avait déjà commencé légèrement et donc qu'une petite distribution des minéraux dans le collagène était déjà présente. Ce n'était toutefois qu'un pré-requis, le but étant ici de démarrer avec le processus déjà engagé.
Finalement, la condition au bord, quand la taille $x$ est nulle est apparue suite à de nos nombreuses discussions avec l'équipe des biologistes. Quand la taille des cristaux $x$ est très petite,voire proche de $0$ (par fragmentation ou initiation du processus), il se peut parfaitement que ces derniers recommencent à grossir toujours en suivant la loi des nucléateurs et inhibiteurs, mais en tenant compte de l'évolution totale du nombre de minéraux au cours du temps. En revanche, plus la structure est minéralisée, moins le processus aura le temps de s'enclencher, empêchant par là-même une sur-minéralisation malheureuse (voir figure 5).
Les expériences qui nous ont permis à ce stade de construire ce modèle, de le consolider et de le simuler avec des paramètres issus de l'observation proviennent quasiment toutes du laboratoire de mon collègue à New York. Mais évidemment sans casser un seul os d'enfant ou d'adulte il fallait tout de même mener des observations suffisamment proches de notre organisme. La réponse fut trouvée dans les arêtes de hareng. En effet, la structure collagénique, la minéralisation et tous ses mécanismes inhérents se trouvent, avec plus ou moins de technicité, observables et mesurables à foison, ou du moins tant que le stock de hareng le permet. C'est une étudiante qui se chargea tous les matins de passer devant la même poissonnerie pour acheter une certaine quantité de harengs à dépiauter et analyser dans la journée. Biologiste chevronnée, elle est désormais professeure en Allemagne et je ne peux pas m'empêcher de penser à tous ces pauvres poissons qui finirent sous un microscope plutôt que dans l'assiette d'un amateur de rollmops.
L'observation des arêtes a non seulement réussi à proposer des avancées dans ce domaine de recherche, elle a aussi et surtout amené notre connaissance à faire des bonds non négligeable sur la relation entre minéralisation et propriétés mécaniques des structures des fragments à une échelle supérieure. Revenus à la fameuse fable de La Fontaine, nous voilà sur le chemin de la seconde partie de notre travail dans l'analyse de la résistance, la dureté et l'élasticité du fagot suivant l'état de fraîcheur des brindilles qui le composent.
En effet, en fonction de l'état de la minéralisation de nos os, comme nous l'avons vu plus haut, et de façon qui pourrait nous sembler contre-intuitive, plus un os est minéralisé, plus il sera facile de le fracturer. Une équipe de Brême en Allemagne s'était penchée sur le sujet en 2010. Tentant de comprendre les effets de la maturité de la structure osseuse sur les paramètres de leur modèle, Ott et ses co-auteurs [4] publièrent un article décrivant assez précisément la courbe de la contrainte (stress) en fonction de la déformation (strain) à partir de la loi de Ramberg-Osgood, assez connue des bio-mécaniciens.
Pour la résumer brièvement, la contrainte quand elle est exprimée en fonction de la déformation présente plusieurs partie: une croissance linéaire qui correspondrait à un élastique que l'on tire et qui revient sur lui même. On appelle d'ailleurs cette phase déformation élastique. Tirer encore plus fort, l'élastique passera un moment donné un point limite appelée yield point ou point de limite élastique à partir duquel il ne reprendra plus sa forme. Et au contraire, une petite contrainte aura un effet de grande déformation, un peu comme un vieil élastique tout usé sur lequel on tire. Cette phase appelée déformation plastique se comporte de façon non linéaire. Elle croît jusqu'à la limite de résistance à la traction, puis ne réagit plus et en tirant un peu plus, elle cède. C'est la limite de la rupture. La loi assez connue de Rambert-Osgood permet de résumer le processus de la façon suivante:
$$\varepsilon = \dfrac{\sigma}{E}+\beta ( \dfrac{\sigma}{E})^n,$$
où la déformation (strain) $\epsilon$ suit d'abord linéairement l'évolution de la contrainte $\sigma$, où $E$ est ce qu'on appelle le module de Young qui vérifie la loi de Hooke
$$\sigma=E\varepsilon.$$
Les constantes $n$ et $\beta$ dépendant du matériau, elle sont adaptés aux arêtes de hareng ou à l'os de mammifère. Les auteurs observèrent et tentèrent de trouver les bonnes valeurs de paramètres pour déterminer le yield point suivant l'avancée en minéralisation de l'os. Ils montrèrent ainsi que plus l'âge avance, plus le yield point baisse et se déplace vers la gauche signifiant une sensibilité accrue aux contraintes imposées sur le matériau. Ils décrivirent également comment le point de rupture se déplaçait lui aussi dangereusement avec le squelette vieillissant.
Notre idée fut alors de coupler ces travaux d'échelle macroscopique à celui de la minéralisation en continu à l'échelle microscopique précédents. Ainsi, sans cloisonner par tranche d'âge les mesures et observations de nos collègues de Brèmes, nous tentions de proposer une relation multi-échelle, continue, pas suivant l'âge moyen des personnes, mais de leurs os. Encore perfectible, nous travaillons à affiner toutes les parties de nos équations pour obtenir un modèle multi-échelle satisfaisant. L'approche étant différente, elle permettrait alors dans un futur heureux nous l'espérons, pouvoir mesurer la réponse des os aux contraintes, non pas suivant que l'on soit né puissant ou misérable, que l'on soit le vieillard ou l'un de ses enfants, mais bel et bien selon la façon dont nous aurons pris soin de notre charpente. Étrangement, nous l'avons vu, c'est en la bousculant que nous rajeunissons nos structures, un peu comme les adultes dont le métier est au contact de la jeunesse. En étant bousculé quotidiennement par leurs questions, leurs revendications, notre remise en question permanente nous oblige à rester alerte, en éveil, à faire preuve de souplesse et à ne pas rompre comme de vieux chênes au pied des roseaux.
Notre aventure ne s'est évidemment pas arrêtée avec les harengs. L'épidémie de covid nous a contraints à faire une pause et de laisser les harengs vivre leur sort habituel de mets de choix dans les assiettes. Changeant notre fusil d'épaule, nous nous sommes focalisés sur la machinerie complexe des ostéoblastes. En effet, tout démarre et s'arrête avec elles. Nous nous sommes décidés à aller plus loin dans notre approche multi-échelle. La production des protéines inhibitrices aussi bien que celle connue sous le nom de nucléateurs proviennent toutes de cette cellule remarquable. Comment le système s'enclenche : nous le savons, c'est par la détection de la dureté de la matrice grâce à des capteurs extra-cellulaires. Qu'est-ce qui en sort, nous le savons aussi, les protéines SIBLING en sont le fruit de ces observations. Que se passe-t-il entre l'entrée de l'information et la sortie des protéines ? C'est l'inconnue totale que nous nous sommes empressés d'observer, de mesurer, d'analyser et de modéliser (voir figure 6).
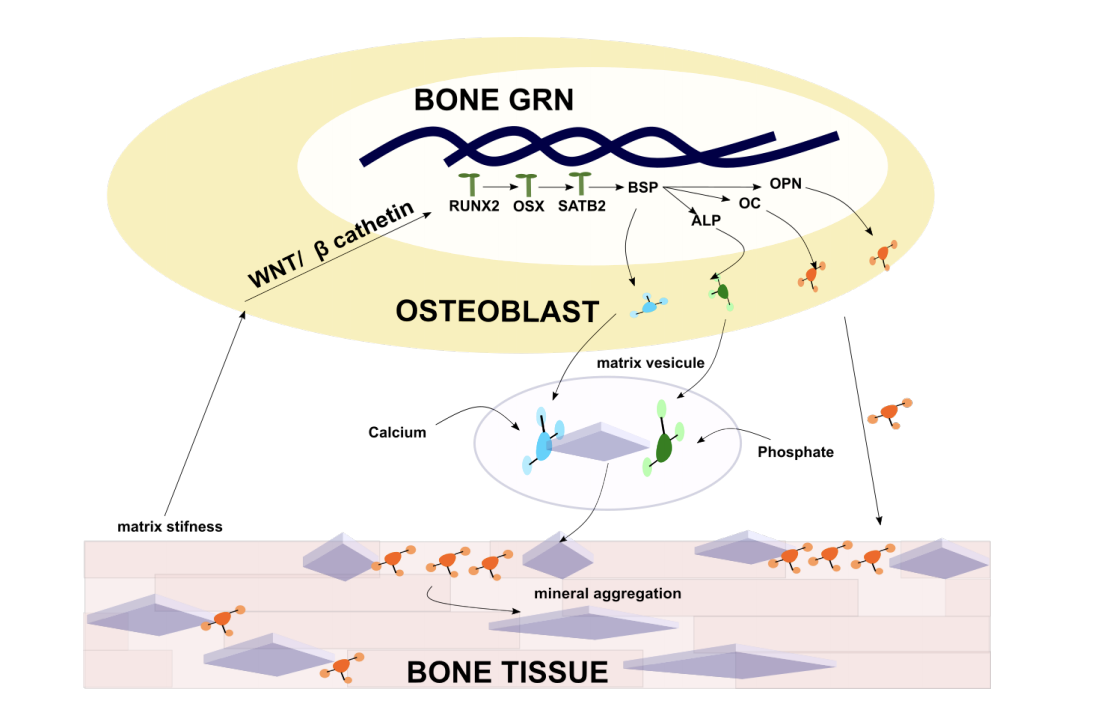
En terra incognita, il a fallu faire preuve de stratégies inhabituelles mais qui ont l'air de marcher pour sélectionner les meilleures fonctions candidates au modèle, tout en restant dans une description mécaniste cohérente avec les interactions chimiques en cascades que l'on a l'habitude de modéliser. Malheureusement, ou bien heureusement, tout dépend du point de vue, très peu d'études sur ce sujet ont été publiées et aucun modèle n'existe. Devant un paysage totalement vierge, nous nous sommes donc enfoncés, avec la même motivation et le même enthousiasme qu'il y a près de 8 ans pour proposer le tout premier modèle de réseau de régulation des gènes contrôlant la minéralisation. L'approche étant longue et nécessitant trop d'explications techniques, nous invitons les curieux à lire les détails dans [2]. Nous pouvons juste ajouter à ce stade, que grâce à ce travail, nous avons pu prouver de façon fortuite l'importance que jouent les micro-ARN dans la régulation de production des protéines. Comme des petits boulets, ces protéines décident de ralentir ou non le processus. L'intérêt pour ces petites molécules est en train d'exploser dans la communauté de l'os, et notre résultat permet, nous l'espérons d'apporter une pierre non négligeable dans la compréhension de phénomènes encore assez flous et complexes.
Les magiciens d'os
Ces clés en mains, nous pourrons par la suite, ordonner aux ostéoblastes posées sur des matrices artificielles de collagène de minéraliser à souhait, tout en contrôlant très finement la souplesse, la dureté, l'élasticité du matériaux et proposer enfin des prothèses adaptés pour les jeunes enfants. Ce travail est le fruit de la publication récente écrite en temps de pandémie et de publications à venir.
Mais ce n'est toujours pas terminé. Une fois les boucles de rétrocontrôles de toute cette machinerie bien maîtrisée et validée par plusieurs expériences, nous serons également capables, en tous les cas, nous l'espérons, de fouiller au plus profond de nos cellules les causes des pathologies liées à l'os, les effets à grande échelle et proposer pourquoi pas des stratégies thérapeutiques nouvelles à une échelle protéinique. La route est encore longue, mais les enjeux de santé, le potentiel des interactions industriels sont enthousiasmants.
N'oublions pas dans cette histoire les outils mathématiques qui nous sont à chaque fois d'une grande aide. La théorie a été jusqu'ici peu sollicitée dans le sens où pour l'instant, la validation des modèles par l'expérimentation et la simulation nous ont obligé à marquer le pas sur l'analyse des équations. On se dit quand même que des modèles multi-échelles combinant des équations aux dérivées partielles structurées en âge, avec des équations de Smoluchowski (que l'on peut finalement compliquer à souhait) en rajoutant des effets retards dus à l'inertie de la production de protéines à l'échelle microscopique, et une loi de Ramber-Osgood liant le tout que l'on pourrait affiner encore plus suivant les prochaines expérimentations présagent un cocktail des plus intéressants pour ouvrir la voie à des études d'équilibre, de stabilité, de bifurcations et de zones saines ou pathologiques à identifier. Même si elle résiste un peu pour l'instant, nous espérons que l'étude théorique de ce problème ne fera pas de vieux os.
Références
[1] A. Chekroun, L. Pujo-Menjouet, and J-P. Berteau. A novel multiscale mathematical model for building bone substitute materials for children. Materials, 11(6), 2018.
[2] A. Chekroun, L. Pujo-Menjouet, S. Falcoz, K. Tsuen, K. Yueh-Hsun Yang, and JP. Berteau. Theoretical evidence of osteoblast self-inhibition after activation of the genetic regulatory network controlling mineralization. Journal of Theoritical Biology, pages 1–12, 2022.
[3] S.V. Komarova, L. Safranek, J. Gopalakrishnan, M-J. Yvonne Ou, M. D McKee, M. Murshed, Rauch F., and E. Zuhr. Mathematical model for bone mineralization. Frontiers in Cell and Developmental Biology, 3(51) :1–11, 2015.
[4] I. Ott, R. Kienzler, and R. Schröder. Aging in the cortical bone: a constitutive law and its application. Arch. Appl. Mech., 80 :527–541, 2010.
Contact
Laurent Pujo-Menjouet est maître de conférences à l'Université Claude Bernard, membre de l'Institut Camille Jordan (ICJ - UMR5208 - CNRS/École centrale de Lyon/Insa de Lyon/Université Claude Bernard/Université Jean Monnet).

